Um gás se caracteriza, principalmente, pelas
propriedades de poder apresentar compressão e de
poder expandir-se.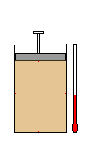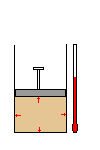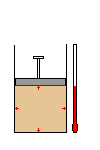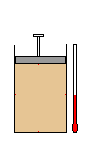
O gás
apresenta uma compressão; seu volume diminui.
Na
expansão, o volume aumenta.
Um gás ocupa todo
o volume do recipiente que o contém, exercendo,
sobre suas paredes, uma mesma pressão.
O gás ocupa de
maneira homogênea, todo o volume do recipiente e
exerce a mesma pressão sobre as suas paredes.
As principais
variáveis de estado de um gás são o volume, a
pressão, e a a temperatura. Isso quer dizer que
, ao estudarmos o comportamento de um gás,
devemos levar em consideração essas três
variáveis.
Um gás ocupa o
volume V, sob pressão P, na temperatura T.
Transformação ou
evolução de um gás é qualquer modificação
provocada em suas variáveis de estado.


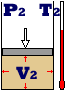
A figura mostra a
transformação de um gás. Nesse caso, houve
modificação nas suas três variáveis.
As condições para
que um gás seja considerado ideal são:
1- o volume
próprio de suas moléculas pode ser ignorado;
2- as forças de
coesão entre as moléculas são desprezíveis;
3- em conseqüência
das condições anteriores, um gás ideal ou
perfeito não apresenta mudança de fase;
4- entre suas
moléculas, não existe qualquer espécie de
integração (influência), a não ser no caso de
colisões, consideradas perfeitamente elásticas;

Um gás ideal, não
existe qualquer interação entre suas moléculas,
exceto em caso de colisões entre as mesmas e as
paredes do recipiente.
Seguem
rigorosamente as leis de Boyle, Gay-Lussac e
Charles.
Transformação
isotérmica: Uma transformação é considerada
isotérmica, quando se processa com temperatura
constante.
Transformação
isobárica: Uma transformação é considerada
isobárica, quando se processa com pressão
constante, modificando-se o volume e a
temperatura.
Transformação
isométrica: Uma transformação é considerada
isométrica ou isocórica, quando se processa com
volume constante, variam pressão e temperatura.
Transformação
adiabática: Uma transformação é dita adiabática,
quando o gás, ao evoluir, não troca calor com o
ambiente. O gás não recebe nem cede calor.
Condições normais
de temperatura e pressão: (CNTP) Diremos que um
gás está nas CNTP quando sua temperatura é de
0ºC e sua pressão de 1 atm.
Lei de Boyle
(Isotérmica)
Consideremos uma
determinada massa de um gás ideal, encerrado em
um recipiente que possui um êmbolo móvel, sem
atrito.
Experimentalmente,
verifica-se que, variando a pressão P aplicada
sobre o êmbolo, o volume V apresentará, também,
uma alteração.
Desse modo,
podemos construir uma tabela que mostra a
relação entre P e v, sob temperatura constante.
Mantendo-se
constante a temperatura de um gás, e aumentando
a pressão, seu volume diminui; P
a
1/V.
logo P1V1 = P2V2
Exemplos: Um gás
se encontra sob pressão de 2,0 atm, em um
recipiente cilíndrico de volume 50 cm3.
O gás é comprimido isotermicamente até o volume
alcançar 27 cm3 . Calcular a pressão
nesse estado.
R...3,7 atm
2- Um gás ocupa um
volume de 60 cm3
sob pressão de 1,2 atm. Calcular seu volume sob
pressão de 2,8 atm e à mesma temperatura.
R..25,7 cm3
3- Um gás tem
pressão de 3 atm e ocupa determinado volume.
Determinar a que pressão seu volume será
reduzido à metade, em uma transformação
isotérmica.
R...6 atm
Lei de Gay -
Lussac (isobárica)
Um recipiente
cilíndrico que contém uma determinada massa de
um gás, inicialmente a 0ºC. Sobre o êmbolo é
exercida uma pressão P, constante.
Aumentando-se a
temperatura de um gás e mantendo-se a pressão
constante, o volume também aumentará.
logo V1/V2 = T1/T2
V1/T1 = V2/T2 = cte.
Em uma mesma
pressão, é constante o quociente entre o volume
e a temperatura Kelvin de um gás.
Exemplo:
1- Um gás tem
volume de 600 cm3 , a 27ºC, e sofre
uma transformação isobárica. sabendo-se que seu
volume alcançou 900 cm3
, determinar a temperatura nesse estado.
2- Um gás tem
volume de 200cm³, a 127ºC. Calcular seu volume a
273ºC, sabendo-se que sofreu uma transformação
isobárica.
3- A temperatura d
certo volume de gás, sob pressão normal, vale
20ºC. A que temperatura seu volume será
duplicado, sob mesma pressão?
4- Determinada
massa de um gás está contida em um recipiente de
volume 6 litros e a 0ºC. Ele sobre uma
transformação isobárica e sue volume é reduzido
para 3 litros. Calcular a temperatura final.
5- Um gás tem
volume 0,40 m³ a uma temperatura de 127ºC.
Calcular de quanto devemos reduzir sua
temperatura para que seu volume alcance
0,30m³, em uma transformação isobárica.
Lei de Charles
(Isométrica)
Consideremos uma
certa massa de um gás, encerrada em um
recipiente, como mostra a animação, vamos
admitir que Po seja a pressão inicial a
0ºC. Aquecemos o gás e mantendo o volume
constante, verifica-se um acréscimo de
temperatura e pressão. Esse procedimento permite
determinar a relação entre pressão e temperatura
de um gás, sob volume constante.
Sob volume
constante, um aumento de temperatura acarreta um
aumento de pressão.
logo P1/P2 = T1/T2
P1/T1 = P2/T2 = cte.
Em um mesmo
volume, é constante o quociente entre a pressão
e a temperatura Kelvin de um gás.
Exemplo:
1- Um gás tem
pressão de 2,7 atm a 27ºC. Calcular sua pressão
a 127ºC, com o mesmo volume.
R...3,6 atm
2- A temperatura
de um gás é de 27ºC a sua pressão vale 1,5 atm.
Determinar a temperatura que o gás deve atingir.
em uma transformação isométrica, para que sua
pressão se torne igual a 3,8 atm.
3- A que
temperatura um gás possui pressão igual à metade
da que tem a 47ºC, supondo-se o seu volume
constante?
4- Um gás ocupa um
volume de 4,0 litros, na temperatura de 157ºC e
pressão 3,0 atm. Ele sofre uma transformação
isométrica e a temperatura varia de -100ºC.
Calcular a variação da pressão.
5- Sob que pressão
um gás adquiri temperatura igual a u terço da
que tem, com pressão de 2,7 atm, admitindo-se o
seu volume constante?
Equação dos gases
ideais
Em todas as
transformações gasosas, consideramos uma das
suas variáveis de estado constantes. Entretanto,
na evolução de um gás, a pressão, o volume e a
temperatura podem variar simultaneamente.
Logo:
P1V1/T1 = P2V2/T2 equação dos gases
perfeitos
Exemplos:
1- Um gás tem
pressão de 2,0 atm, temperatura de 127ºC e ocupa
um volume de 10 litros. Determinar sua
temperatura com pressão de 3,0 atm e volume de
6,0 litros.
R 87ºC
2- Sabendo-se que
15 litros de um gás estão a 27ºC e sob pressão
de 2,0 atm, calcular seu volume, a 17ºC e 3,0
atm.
3- Um gás está a
uma temperatura de 27ºC e tem volume V1 e uma
pressão P1. Calcular a sua temperatura, caso o
volume seja reduzido à metade e a pressão,
triplicada.
4- Um gás a 67ºC e
pressão de 1370 mm Hg, ocupa um volume de 600
cm³. Determinar que volume ocupará nas C.N.T.P.
5- Um gás a 25ºC e
760mm Hg, ocupa um volume de 125 cm³. Determine
sua pressão a 80ºC e volume de 310cm³.
Estudo dos Gases Ideais – Exercícios.
1
- O gráfico mostra a isoterma de um gás, ao
passar de estado 1 para o estado 2. Calcular o
volume no estado 2.
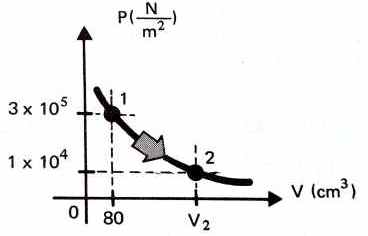
2-
Um gás tem pressão de 2 atm e ocupa um certo
volume. Calcular a que pressão seu volume será
reduzido à terça parte, sob temperatura
constante.
3-
Um gás sofre uma transformação isotérmica e os
valores da pressão e do volume foram tabelados.Pede-se:
|
P (atm) |
0,60 |
1,2 |
|
3,4 |
4,0 |
|
7,2 |
|
V (m³) |
0,30 |
|
0,069 |
0,053 |
|
0,033 |
|
-
Complete a
tabela;
-
Determine o
valor da constante de proporcionalidade k;
-
Construa o
gráfico P x V.
4
– O gráfico representa uma transformação
isobárica de um gás. Calcular:
-
O volume no
estado 2;
-
A temperatura
no estado 3.
.jpg)
5- O
gráfico mostra como varia a pressão em função da
temperatura, na transformação isométrica de um
gás. Determinar a pressão a 00C.
.jpg)
6-
Um recipiente de volume 0,015 m³ guarda 50g de
C02 sob pressão de 3,0 atm. Calcular:
-
O número de
mols;
-
A temperatura
do gas.
7- Um recipiente de volume 50 litros, contém
nitrogênio (N2). A temperatura do
recipiente é de 200 C e a pressão em
suas paredes é de 700 mm Hg. Calcular a massa de
nitrogênio contida no recipiente.
8- Um recipiente de volume 1,6 x 104
cm³ contém 64 g de oxigênio, a 370C.
Determinar a pressão que se exerce sobre as
paredes do recipiente.
9- Um recipiente de volume igual a 0 040 m³
contém 88g de C02 a uma temperatura
de 270C. Determinar:
-
A velocidade
média de suas moléculas;
-
O número de
moléculas no recipiente;
-
A pressão
sobre as paredes do recipiente;
-
A energia
cinética do gás;
-
A energia
cinética média de cada molécula.
10- Um recipiente encerra determinada massa de
hidrogênio (H2) na temperatura de 270C.
Calcular:
-
a velocidade
médias de suas moléculas;
-
a energia
cinética média por molécula.
11- Uma certa massa gasosa ocupa um volume de
4,0 litros, com pressão de 1 atm. Calcular a
energia cinética desse gás.
12- Um recipiente de volume igual a 5 litros
contém 3 mols de C02. Sabendo-se que
a velocidade média de suas moléculas é de 2 x 102
m/s, determinar:
-
a massa de C02
;
-
a pressão
sobre as paredes do recipiente;
-
a temperatura
do gás;
-
a energia
cinética do gás.
Equação de estado para um
gás ideal: ( Equação de Clapeyron).
1- Massa molecular de
um gás (M)
A massa a molecular de um
gás é a soma das massas atômicas dos átomos que
constituem a sua molécula. Consideremos, por
exemplo, o anidrido carbônico, (CO2):
C = 12
O = 16 => CO2
=> 12 +16 + 16 = 44g
2- Mol de um gás
É a quantidade de gás cuja
massa é igual à massa molecular:
1 mol de CO2
= 44g
3- Um mol de qualquer
gás contém o mesmo número de moléculas.
1 mol => 6,02 x 10
23 moléculas =>
número de Avogadro.
4 - Número de Mols
(n)
É o quociente entre certa
massa (m) do gás e a sua massa molecular (M).
n = massa do
gás (m)
==> n = m/M
massa molecular (M)
por exemplo, 132 gramas de
CO2 corresponde a 3 mols.
n = m/M => 132/44 = 3
5- Nas condições
normais de temperatura ( T = 273 K) e pressão (P
= 1 atm), um mol de qualquer gás ocupa um volume
de 22,4 litros.
1 mol =>
 => V = 22,4 l
=> V = 22,4 l
Consideremos, então a equação geral dos gases
ideais:
 = k (cte)
= k (cte)
A experiência
mostra que a constante k depende, diretamente do
número de mols contidos no volume ocupado pelo
gás, isto é, k
∞
n.
A outra constante que
transforma esta relação de proporcionalidade em
uma igualdade é R (constante universal dos
gases) e podemos escrever:
K =
nR retornando a equação geral, temos : PV/T = nR
PV = nRT (Equação de
estado)
Obs.: O valor de R pode ser
calculado se considerarmos as observações feitas
anteriormente:
PV = nRT = > R =
PV/nT
R = 1 atm x 22,4 litros
/ 1 mol x 273 K = 0,082 atm.l/mol.K ou 82
atm. cm3/mol.k
R = 1,013 x 105 Pa
x 22,4 x 10 -3 m3 / 1mol x
273K = 8,31 joule/ mol. Kelvin
Exercício: 1) Sessenta e seis
gramas de CO2 estão sobre pressão de
3,0 atm e ocupam um volume de 0,012 m3
. Determinar:
a) o número de mols;
b) a temperatura do gás.
2) Qual a massa de oxigênio
(O2 ) que devemos injetar em um
recipiente de volume igual a 12 litros, para que
sob pressão de 3,0 atm, apresente temperatura de
27ºC? R = 47g
3) Um recipiente de volume
0,015 m3 guarda 50g de CO2
sob pressão de 3,0 atm. Calcular:
a) o número de mols;
R = 1,14 mols.
b) a temperatura do gás.
R = 208o C
4) Um recipiente de volume
igual a 50 litros contém nitrogênio (N2).
A temperatura do recipiente é 20o C e
a pressão em suas paredes é de 700 mmHg.
Calcular a massa de nitrogênio contida no
recipiente.
R =
53 g
5) Um recipiente de volume
1,6 x 104 cm3 contém 64 g
de oxigênio, a 37o C. Determinar a
pressão que exerce sobre as paredes do
recipiente.
R = 3,2 atm
6) Um recipiente de volume
2,0 litros contém C02 , sob pressão
de 2,0 atm e temperatura 27o C.
Calcular:
a) o número de mols;
R = 0,16 mol
b)a massa de CO2
contida no recipiente.
R = 7g
7)Cento e sessenta gramas
de CO2 estão a 127ºC e exercem uma
pressão de 3,0 atm nas paredes do recipiente.
Calcular o volume do recipiente.
R 54,7 L
8) O recipiente da figura
abaixo é cilíndrico e o raio de sua base vale
16cm. Ele contém 88g de CO2 , sob
pressão de 2,5 atm e temperatura de 0º C.
Calcular a altura do êmbolo em relação à base.
R = 22,3 cm
.png)
9) Se, no exercício
anterior, o êmbolo for abaixado até a altura de
15 cm, calcular a pressão, sabendo-se que o
termômetro marca 57o C.
R 4,5 atm
TEORIA CINÉTICA DOS
GASES
Sabemos que as moléculas de
m gás possuem grande liberdade de movimento e
que a trajetória de qualquer uma dessas
moléculas pode ser esquematizada por uma linha
quebrada, como mostra a figura que se segue.

Cada molécula do gás
executa um movimento desordenado, mas que pode
ser considerado retilíneo, durante o intervalo
de duas colisões.
Os segmentos, que
representam deslocamentos, possuem as mais
variadas extensões e direções.
A teoria cinética dos gases
estuda este comportamento molecular, procurando
explicar, através desse movimento desordenado e
consequentes colisões, a pressão, a temperatura
e a sua energia cinética.
A teoria cinética dos gases
aceita o fato de que as leis da mecânica são
aplicáveis ao movimento das moléculas e admite
as seguintes hipóteses:
a) as moléculas possuem um
movimento desordenado, com velocidade bastante
variáveis, mas que permite estabelecer uma
velocidade média para essas moléculas;
b) as moléculas possuem
dimensões que podem ser ignoradas, em comparação
com os espaços vazios existentes entre elas;
c) as colisão das moléculas
entre si e com as paredes do recipiente são
perfeitamente elástica. Isso significa que a
energia cinética dessas moléculas se conserva.
INTERPRETAÇÃO CINÉTICA DA
PRESSÃO
A pressão exercida por um
gás, contido em um recipiente, é devida as
inúmeras e incessantes colisões dessas moléculas
contra as paredes desse recipiente. Não se pode
observar o efeito individual de cada molécula,
mas admite-se um efeito médio, responsável pela
ação de uma força, também médias, sobre as
paredes.
A relação matemática que
permite determinar a pressão que um gás exerce
pode ser escrita:
 onde: m = massa de
gás contida no recipiente;
onde: m = massa de
gás contida no recipiente;
v = velocidade média de
suas moléculas,
V = volume ocupado pelo
gás.
INTERPRETAÇÃO CINÉTICA DA
TEMPERATURA
Vamos procurar relacionar,
agora, a temperatura (Kelvin) do gás com a
velocidade media de suas moléculas.
 ==>
==>
 ==>
==>
 ==>
==>
 ==>
==>
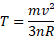
 ==>
==>
 ==>
==>

INTERPRETAÇÃO
CINÉTICA DA ENERGIA CINÉTICA
Admitindo-se que
cada molécula do gás tenha massa igual a
m
e, sendo v a velocidade
média das moléculas, a energia cinética média de
cada molécula será:
Sabendo que a energia
cinética total do gás é a soma das energias
cinéticas médias das moléculas, o que nos
permite escrever:
Calor e trabalho
O calor pode ser convertido em trabalho e que
trabalho pode-se transformar em calor. A
utilização dos gases e vapores nesse processo de
transformação encontra aplicações na prática
cotidiana.
A animação mostra um gás em uma transformação
isobárica. Ao receber calor Q, seu volume
aumente de V1 para V2 e, segundo a lei de
Gay-Lussac, a temperatura também aumenta de T1
para T2.





A força média F é responsável pelo deslocamento
H e a conseqüente variação de volume
DV. A variação de
volume é o volume do cilindro indicado e vale:
DV = SH.
W = P (V2 - V1)
Na expansão V2>V1 => DV
>0 => w >0
Na compressão V2<V1 => DV
<0 => w< 0
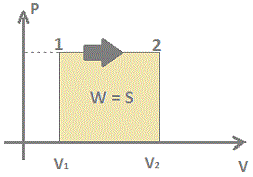
A área sob a curva do gráfico PxV, de um gás é
numericamente igual ao trabalho realizado.
Exemplo:
1- Um gás, sob pressão de 1 atm, ocupa um volume
de 600 cm³ a 27ºC. Ele sofre uma transformação
isobárica e sua temperatura alcança 127ºC.
Calcular o trabalho realizado pelo gás.
2- Um gás, sob pressão de 1,5 atm e temperatura
0ºC ocupa um volume de 400cmº. Ele sofre uma
transformação isobárica e a temperatura alcança
100ºC Pede-se:
a) Calcular o trabalho realizado pelo gás;
b) construir o gráfico PxV.
3- Um gás, sob pressão de 1,8 atm e temperatura
de 167ºC, ocupa um volume de 800 cm³. Ele sofre
uma transformação isobárica e sua temperatura
atinge 17 ºC. pede-se:
a) calcular o volume a 17ºC;
b)calcular o trabalho realizado.
PRIMEIRO PRINCÍPIO DA TERMODINÂMICA.
Sabemos que um gás pode realizar trabalho,
quando absorve determinada quantidade de calor.
Entretanto, a experiência mostra que nem todo
calor recebido é transformado em trabalho. Parte
deste calor é utilizado pelo próprio gás e, no
caso da transformação isobárica, a diferença
calor - trabalho é necessária para manter a
mesma pressão com volume maior. Segundo a lei de
Gay-Lussac, um aumento de volume é acompanhado
de um correspondente aumento de temperatura, e
sabemos que variações de temperatura indicam
variações de energia interna (
DU).
Q = W + DU
onde Q = calor trocado com o meio ambiente.
W = trabalho realizado.
DU = variação da
energia interna.
Exemplos.
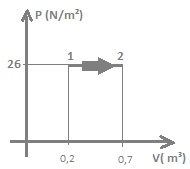
1- O gráfico acima mostra como varia o volume de
um gás, sob pressão de 26 N/m², ao absorver 22
calorias. Dados 1 cal = 4,18J
Calcular:
a) o trabalho realizado pelo gás;
b) a variação da sua energia interna.
2- Um gás ocupa um volume de 2m³ na temperatura
de 73ºC, com pressão de 130 N/m². Ao absorver
975 J de energia, sofre uma transformação
isobárica, e o volume alcança 5 m³. Pede-se:
a) calcular a temperatura final;
b)calcular o trabalho realizado;
c) construir o gráfico VxT (K) e PxV;
d)calcular a variação da energia interna.
3- Um gás tem volume de 0,062 m³ sob pressão de
1 atm. Ao absorver 1200 calorias, o volume passa
isobaricamente para 0,084 m³. Calcular:
a) o trabalho realizado;
b) a variação da energia interna.
SEGUNDO PRINCÍPIO DA TERMODINÂMICA
De uma maneira geral, toda maquina
térmica que opera em ciclos retira o calor Q1 de
uma fonte quente (T1), realiza um trabalho W, e
rejeita o calor Q2 ( não convertido em
trabalho), denominada fonte fria.
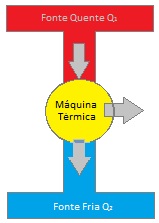
Pelo princípio da conservação da energia, Q1 = W
+Q2, percebe-se que W < Q1. Isso que dizer que
uma máquina não pode, na prática, transformar
todo calor recebido em trabalho útil. Sempre há
perdas de energia.
è impossível construir uma máquina térmica que,
operando em ciclos, transforme todo o calor
absorvido em trabalho.
Este princípio permite definir rendimento de uma
máquina térmica.
rendimento é o quociente entre o trabalho útil
realizado e o calor absorvido.
r = W/Q1
sendo W = Q1-Q2 logo = Q1 - Q2 / Q1
r = 1 - Q2/Q1 => r 1 - T2/T1
Exemplos:
1- Qual é o rendimento de uma máquina térmica
que retira 200 cal da fonte quente e rejeita 120
cal para fonte fria?
2- Uma máquina térmica recebe, a cada ciclo,
1000J de energia e rejeita 600J. Se ela trabalha
com fonte fria de 27ºC, calcular a temperatura
da fonte quente.
3- Um gás sofre uma variação isométrica,
recebendo 300 cal. Determinar o trabalho que
realiza e a variação da sua energia interna.
Trabalho Calor – Primeira e segunda Lei da
termodinâmica – Exercícios
-
Um gás, sob
pressão de 1,5 atm e temperatura de 00C,
ocupa um volume de 400 cm³. Ele sofre uma
transformação isobárica e a temperatura
alcança 1000C. Pede-se:
-
Calcular o
trabalho realizado pelo gás;
-
Construir o
gráfico P x V.
-
O gráfico
representa a transformação de um gás.
Pergunta-se:
.jpg)
-
Qual a
natureza da transformação?
-
Qual o
trabalho realizado.
-
Um gás sofre
uma transformação isobárica, sob pressão de
1 atm, e que pode ser representada pelo
gráfico. Calcular o trabalho realizado.
.jpg)
-
Apresentamos,
nessa questão, dois gráficos, que apresentam
transformações gasosas. Calcular os
trabalhos realizados.
.jpg)
-
Um gás tem
volume de 0,062 m³ sob pressão de 1 atm. Ao
absorver 1200 calorias, o volume passa
isobaricamente para 0,084 m³. Calcular:
-
O trabalho
realizado;
-
A variação da
energia interna.
-
Um gás,
variando sob pressão constante e igual a 46
x 10³ N/m², apresenta uma alteração de
volume, segundo o gráfico. Sabendo-se que
recebeu 1130 cal, calcular:
.jpg)
-
O volume
inicial;
-
O trabalho
realizado;
-
A variação de
energia interna.
-
Os gráficos a
seguir mostram duas transformações gasosas.
No caso A, o gás absorve 5,0J e no caso B,
cede 5J. Calcular:
.jpg)
-
O trabalho
realizado em cada caso;
-
As respectivas
variações de energia interna.
-
O gráfico a
seguir representa uma transformação de um
gás com pressão constante e igual a 1,1 x 104
N/m², e que recebeu 1302 cal. Calcular:
.jpg)
-
A temperatura
no segundo estado;
-
O trabalho
realizado;
-
A variação de
energia cinética.
-
O gráfico a
seguir representa uma compressão isobárica
de 2 mols de um gás, que, durante a
transformação, cede 8263 joules ao ambiente.
Determinar:
.jpg)
-
A pressão do
gás;
-
O volume no
estado 1;
-
O trabalho
realizado;
-
A variação da
energia interna.
-
Determinar a
quantidade de calor recebida por uma máquina
térmica que realiza um trabalho de 200J com
rendimento de 15% .
-
Qual o
rendimento de uma máquina térmica que retira
200cal da fonte quente e rejeita 120 cal
para fonte fria?
-
Determinar o
rendimento de uma máquina térmica que
funciona segundo o ciclo de Carnot e entre
duas fontes 300 C e 1700C.
-
Sendo de 20% o
rendimento de uma máquina térmica e de 800C
a diferença entre as temperaturas de suas
fontes, determinar a temperatura das fontes.
-
Uma máquina
térmica recebe, a cada ciclo, 1000J de
energia e rejeita 600J. Se ele trabalha com
uma fonte fria de 270C, calcular
a temperatura da fonte quente.
-
Ao fornecermos
1400J de energia a um gás, seu volume passou
de 10 m³ para 20 m³ . Sabendo-se que,
durante o processo a pressão permaneceu
constante e igual a 50 N/m², determinar:
-
O trabalho
realizado pelo gás;
-
A variação da
energia interna do gás.
-
Um gás sofre
uma variação isométrica ( volume constante),
recebendo 300 cal. Determinar o trabalho que
realiza e a variação da energia interna.
-
Em uma
determinada transformação, um sistema recebe
800 cal e realiza um trabalho de 1200J. Qual
é a variação de energia interna?
|
Testes para
consolidar seus conhecimentos
Assinale com V as
afirmações verdadeiras e com F as
afirmações falsas:
1-
( ) Calor e trabalho constituem
modalidades idênticas de energia.
2-
( ) A troca de calor entre um
sistema e o exterior implica
necessariamente numa diferença de
temperatura entre ambos.
3-
( ) A troca de trabalho entre um
sistema e o exterior não envolve
diferença de temperatura entre ambos.
4-
( )1 BTU 1054,872
joules. 1054,872
joules.
5-
( ) Numa transformação
isotérmica em que ocorre mudança de
estado, não há variação de energia
interna do sistema.
6-
( ) Na transformação isotérmica
sofrida por uma certa massa gasosa, o
gás não pode trocar calor com o
exterior, pois a temperatura permanece
constante.
7-
( ) Numa transformação
adiabática, o gás não troca calor com o
exterior.
8-
( ) Qualquer transformação
ocorre sem variação da energia interna
da massa gasosa.
9-
( ) A transformação isométrica
de uma certa massa gasosa só pode
ocorrer se o gás trocar calor com o
exterior.
10-
( ) Para a mesma variação de
temperatura ∆T, a massa de gás sofre a
mesma variação de energia interna, quer
a variação seja isobárica , quer seja
isométrica.
11-
( ) Se a energia interna de um
gás permanece constante numa
transformação, esta será necessariamente
isotérmica.
12-
( ) A transformação na qual
ocorre mudança de estado sistema, pode
ser adiabática.
13-
( ) O calor específico de um gás
a volume constante pode ser igual ao
calor específico desse mesmo gás a
pressão constante.
14-
( ) A diferença entre o calor
específico de um gás a pressão constante
e o calor específico do mesmo gás ,
porém a volume constante, é igual à
constante universal dos gases.
15-
( ) Numa transformação
adiabática, sendo ₵ = 3 / 2 R, então
será g
= 5 / 3.
GABARITO: 1F;
2V;3V;4V;5F;6F;7V;8F;9V;10V;11V;12F;13F;14V;15V.
Assinale com X a
alternativa correta:
1-
Calor é:
a-
( ) uma forma de energia que se
atribui aos corpos quentes.
b-
( ) uma forma de energia que não
existe nos corpos frios.
c-
( ) o mesmo que temperatura de
um corpo.
d-
( ) a energia em trânsito de um
corpo para outro, quando entre eles há
diferença e temperatura.
e-
( ) n.d.a.
2-
A compressão de um gás feita
adiabaticamente, exige que:
a-
( ) se retire calor do gás.
b-
( ) se efetue trabalho sobre o
gás.
c-
( ) se ceda calor ao gás.
d-
( ) que se resfrie o gás.
e-
( ) n.d.a.
3-
Uma certa massa m de um gás ideal
recebe a quantidade de calor Q e fornece
o trabalho
t,
passando de uma temperatura T1
para outra temperatura T2. A
variação de energia interna do gás será:
a-
( ) maior se a transformação for
a volume constante.
b-
( ) menor se a transformação for
a pressão constante.
c-
( ) maior se a transformação for
tal que PVk = constante, (P,
V, são respectivamente a pressão e o
volume do gás e k uma constante
característica do gás).
d-
( ) será sempre a mesma não
dependendo da variação de pressão ou de
volume.
e-
( ) n.d.a.
4-
Fornecemos 3 x 105
joules de calor a um gás ideal, e este
realiza o trabalho indicado no gráfico
abaixo, passando do estado inicial i
para o estado final f.

P indica a pressão
e V o volume. Qual a variação de energia
interna do gás nessa transformação?
a-
( ) zero
b-
( ) 1,5 J
c-
( ) 105 J
d-
( ) 2 x 102 J
e-
( ) 5 x 105 J
5-
O diagrama de Clapeyron,
correspondente a uma transformação que
levou o gás do estado inicial i até o
estado final f é mostrado abaixo.

A área hachurada
representa:
a-
( ) trabalho realizado
b-
( ) calor
c-
( )energia interna
d-
( ) variação de pressão
e-
( ) temperatura
6-
Um recipiente de volume V contém
um gás perfeito. Fornece-se ao gás certa
quantidade de calor, sem variar o
volume. Nestas condições tem-se que:
a-
( ) o gás realizará trabalho
equivalente à quantidade de calor
recebida
b-
( ) o gás realizará trabalho e a
energia interna diminuirá
c-
( ) o gás realizará trabalho e a
energia interna permanecerá constante
d-
( ) a quantidade de calor
recebida pelo gás servirá apenas para
aumentar a energia interna do mesmo
e-
( ) n.d.a.
7-
Um gás, recebendo calor, fornece
trabalho nas transformações;
a-
( ) isométrica e isotérmica
b-
( ) isotérmica e adiabática
c-
( ) adiabática e isobárica
d-
( ) isobárica e isotérmica
e-
( ) n.d.a.
8-
Em uma transformação adiabática
(onde não se verificam trocas de calor
com o exterior), o trabalho realizado
por um sistema gasoso:
a-
( ) é proporcional à quantidade
de calor absorvida pelo sistema
b-
( ) é igual, em valor absoluto,
à variação da energia interna do sistema
c-
( ) é sempre nulo
d-
( ) é proporcional à quantidade
de calor cedida pelo sistema
e-
( ) é aproximada mente nulo
9-
Comprimindo-se um gás
adiabaticamente:
a-
( ) a pressão aumentará, mas a
temperatura poderá diminuir
b-
( ) a pressão diminuirá e a
temperatura permanecerá constante
c-
( ) a pressão permanecerá
constante e a temperatura aumentará
d-
( ) a pressão e a temperatura
aumentarão
e-
( ) não haverá alteração na
pressão e na temperatura

O gráfico mostra
como varia a energia interna de um mol
de oxigênio numa transformação
isométrica, quando sua temperatura varia
de 100 K a 200 K. Esse enunciado
refere-se as questões 10 e 11.
10-
A quantidade de calor absorvido
pelo gás, em calorias, foi, nessa
transformação:
a-
( ) 100
b-
( ) 500
c-
( ) 250
d-
( ) 750
e-
( ) 1000
11-
O calor específico do oxigênio,
em cal / (mol.K) vale:
a-
( ) 5
b-
( ) 2,5
c-
( ) 10
d-
( ) 2
e-
( ) 1

A variação
volumétrica de um gás em função da
temperatura à pressão constante de 3 N /
m2, está indicado no gráfico.
Esse enunciado refere às questões 12 e
13.
12-
O trabalho realizado durante a
transformação de A para B é
aproximadamente igual, em joules, a:
a-
( ) 3 x 10-2
b-
( ) 3
c-
( ) 1 / 8
d-
( ) 8
13-
Se, durante a transformação de A
para B, o gás recebeu energia externa
igual a 20 joules, a variação da energia
interna do gás foi igual (em joules) a:
a-
( ) 17
b-
( ) 23
c-
( ) 20
d-
( ) 3
14-
O gráfico abaixo representa uma
temperatura T de um gás ideal, em função
do volume V. Em que transformação a
variação da energia interna do gás foi
nula?

a-
( ) ia
b-
( ) ib
c-
( ) ic
d-
( ) id
e-
( ) ie
15-
Um sistema vai de um estado
inicial (1) a um estado final (2)
através de diferentes caminhos (veja
figura). Em relação ao trabalho recebido
pelo sistema na transformação de (1)
para (2) podemos dizer:
a-
( ) é mínimo na transformação
1-5-2
b-
( ) é máximo na transformação
1-4-2
c-
( ) é o mesmo nas transformações
1-3-2 e 1-4-2
d-
( ) é máximo na transformação
1-3-4-2
e-
( ) é mínimo na transformação
1-4-2

16-
130 g de ar (densidade 1,3 kg / m3
a 00C) são aquecidos de 00C
a 1000C sob pressão
atmosférica. A variação de volume dessa
massa de ar é aproximadamente, em m3,
dada por:
a-
( ) 0,036
b-
( ) 3,6 . 104
c-
( ) 1,36
d-
( ) 0,04
e-
( ) n.d.a.
17-
O calor específico do ar sob
pressão constante é 0,237 cal / g0C.
Para aquecer os 130 g de ar da questão
anterior, nas mesmas condições, são
necessárias aproximadamente:
a-
( ) 3 cal
b-
( ) 3,08 cal
c-
( ) 3,08 . 103cal
d-
( ) uma quantidade bem diferente
das anteriores
18-
Sob volume constante, na questão
anterior, teriam sido necessárias
aproximadamente (relação entre os
calores específicos do ar a pressão
constante e a volume constante cp
/ cv = 1,4):
a-
( ) 2,2 cal
b-
( ) 2,2 . 103 cal
c-
( ) 4,4 cal
d-
( ) 4,4 .103 cal
e-
( ) um número muito diferente
dos anteriores
19 – O calor
específico do ar sob volume constante,
de acordo com os resultados anteriores,
é aproximadamente expresso por:
a-
( ) 2,2 cal / g0C
b-
( ) 0,22 cal / g0C
c-
( ) 1,7 cal / g0C
d-
( ) 0,17 cal / g0C
e-
( ) um valor bem diferente dos
anteriores.
19-
Um sistema termodinâmico,
constituído por massa m de gás perfeito,
evolui de um estado I a um estado II, de
temperaturas TII > TI
(figura a seguir)

De maneira geral,
considerando os parâmetros:
∆Q = calor trocado
com o exterior,
∆t
– trabalho realizado ou recebido do
exterior,
∆u = variação de
energia interna, qual das afirmações é
verdadeira?
a-
( ) ∆Q independe da
transformação que leva de I a II
∆t
independe da transformação que leva de I
a II
∆u independe da
transformação que leva de I para II
b-
( ) ∆Q depende da transformação
que leva de I a II
∆t
depende da transformação que leva de I a
II
∆u depende da transformação que leva
de I a II
c-
( ) ∆Q independe da
transformação que leva de I a II
∆t
depende da transformação que leva de I a
II
∆u independe da transformação que
leva de I a II
d-
( )∆Q depende da transformação
que leva de I a II
∆t
depende da transformação que leva
de I a II
∆u independe da transformação que
leva de I a II
e-
( ) n.d.a.
GABARITO:
1D;2B;3D;4C;5ª;6D;7D;8B;9D;10B;11ª;12B;13ª;
14C;15E;16ª;17C;18B;19D;20D.
|