|
|
|
|
|
|
| |
A pressão é definida pela força suportada
normalmente por unidade de área, tendo,
portanto, por expressão algébrica:

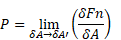
Pressão é a força exercida por um fluido
perpendicularmente a uma superfície, e por
unidade de área dessa superfície. A pressão num
dado ponto no interior de um fluido em repouso é a
mesma para todas as orientações da superfície
que contém esse ponto e aumenta com a
profundidade. Isto se deve ao fato das camadas
que se encontram nos níveis inferiores terem que
suportar o peso das que se encontram por cima.
Num reservatório que contém um gás a pressão
pode considerar-se uniforme porque a densidade
do gás é tão pequena que a variação da pressão
com a profundidade é desprezível, como já se
disse. Em outros fluidos mais densos a pressão
varia na direção vertical, como resultado da
força da gravidade, mas não varia na direção
horizontal, isto é, todos os pontos que se
encontram num mesmo plano horizontal de um fluido
em repouso estão à mesma pressão.
A unidade de pressão no Sistema Internacional é
o Newton por metro quadrado (N/m2) a
que se chama pascal (Pa). 1 Pa= 1 N.m-2
Como esta unidade é muito pequena, na prática
usam-se os seus múltiplos: quilopascal (1 kPa=103
Pa), megapascal (1 MPa=106 Pa).
Outra unidade usada correntemente é a atmosfera
padrão (valor médio da pressão atmosférica ao
nível do mar)
1 atm =101 325 Pa = 101,325 kPa = 1,01325 bar
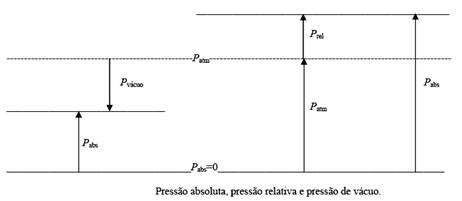
Os aparelhos de medida da pressão denominados
manômetros estão, normalmente, graduados para
indicar a diferença entre a pressão do fluido
(pressão absoluta) e a pressão atmosférica. A
esta diferença dá-se o nome de pressão relativa,
ou manométrica. Para pressões inferiores à
pressão atmosférica, os aparelhos de medida
indicam a diferença entre a pressão atmosférica
e a pressão absoluta do fluido, a que se dá o
nome de vácuo ou pressão de vácuo. O que acabou
de se mencionar está ilustrado na figura abaixo.
Prel = Pabs - Patm
(para pressões superiores a Patm)
Pvac = Patm - Pabs
(para pressões inferiores a Patm)
Sempre que não seja dito o contrário, o termo
pressão refere-se à pressão absoluta.
1.13.1. Temperatura e
Princípio Zero da Termodinâmica
Apesar de nos ser familiar o termo temperatura,
como um conceito físico relacionado com o
nível de agitação molecular do sistema, não
é possível dar uma definição exata de
temperatura. O sentido do tato permite-nos dizer
se um dado corpo está a uma temperatura
superior, ou inferior, à temperatura de outro
corpo, mas não permite atribuir um valor
numérico a essa temperatura. Além disso, os
nossos sentidos podem enganar-nos. Por exemplo,
se tocarmos num pedaço de metal e noutro de
madeira temos a sensação de que o metal está
mais frio do que a madeira apesar de os dois
estarem à mesma temperatura. O fato dos valores
de várias propriedades dos corpos, designadas
propriedades termométricas, mudarem quando se
altera a temperatura vai permitir avaliar com
precisão esta temperatura. Por exemplo, o
funcionamento do conhecido termômetro de
mercúrio e vidro baseia-se na dilatação do
mercúrio com a temperatura. Neste caso a
propriedade termométrica é o comprimento L de
uma coluna de mercúrio contida num tubo capilar
de vidro. Quando se calibram estes termômetros
faz-se corresponder a cada valor de L um valor
numérico θ que é a temperatura.
Define-se desta maneira uma escala empírica de
temperaturas. Em outros tipos de termômetros a
temperatura é determinada por várias outras
propriedades dependentes da temperatura como,
por exemplo, a resistência elétrica de um
condutor, a força eletromotriz de um termopar, a
pressão de um gás mantido a volume constante,
etc. É sabido que, quando se põem em contato
dois corpos a temperaturas diferentes, o corpo
mais quente esfria enquanto que o mais frio
aquece (considerando que não existe mudança de
fase) devido a uma transferência de energia na
forma de calor do corpo quente para o corpo
frio. Entretanto observam-se variações em
algumas das propriedades dos corpos que, ao fim
de algum tempo, cessam. Quando tal acontece
diz-se que os dois corpos alcançaram o
equilíbrio térmico e que estão à mesma
temperatura. A igualdade de temperaturas é a
única condição exigida para o equilíbrio
térmico. O princípio zero da termodinâmica
afirma que:
“Quando dois corpos estão em equilíbrio
térmico com um terceiro, os três estão em
equilíbrio térmico entre si.”
Poderá parecer estranho que este fato, tão
óbvio, seja considerado uma das leis
fundamentais da termodinâmica. Contudo, não pode
deduzir-se de outras leis e a sua importância
deve-se à circunstância de servir de base à
medida de temperaturas. Se o terceiro corpo for
um termômetro pode dizer-se que dois corpos,
mesmo que não estejam em contato, estão em
equilíbrio térmico se em ambos for medida a
mesma temperatura.
1.13.2. Escalas mais utilizadas
• Escala Celsius (ºC) (Anders Celsius,
1701-1744)
- Escala absoluta: escala Kelvin (K) (Lord
Kelvin 1824-1907)
Þ K = ºC + 273,15
• Escala Fahrenheit (ºF) (Gabriel Fahrenheit,
1686-1736)
- Escala absoluta: escala Rankine (R)
Þ R = ºF + 459,67
1.14.1. Energia Cinética: Energia
associada ao movimento da partícula.

1.14.2. Energia Potencial Gravitacional:
Energia associada a posição da partícula com
relação a um dado referencial.

1.14.3. Energia Interna (U):
É a energia associada à translação, à rotação e
à vibração de moléculas, elétrons, prótons e
nêutrons e a energia química decorrente da
ligação entre átomos e entre partículas
subatômicas.
A energia interna é uma propriedade de
fundamental importância e não precisamos saber
seu valor absoluto e sim a sua variação.
1.14.4 . Princípio da Conservação da
Energia
Em um sistema isolado a energia
permanece constante.

| | | |
|
 | |
|
|
|
|
|