As relações entre pressão,
volume específico e temperatura serão
apresentadas para uma substância pura. Uma
substância pura é homogênea. Ela pode existir em
mais de uma fase, mas cada fase deve ter a mesma
composição química, A água é uma substância
pura. As várias combinações de suas três fases
tem a mesma composição química. Para completar,
somente uma substância simples compressível será
considerada(por exemplo uma substância que seja
essencialmente livre de efeitos magnéticos ou de
tensão superficial).
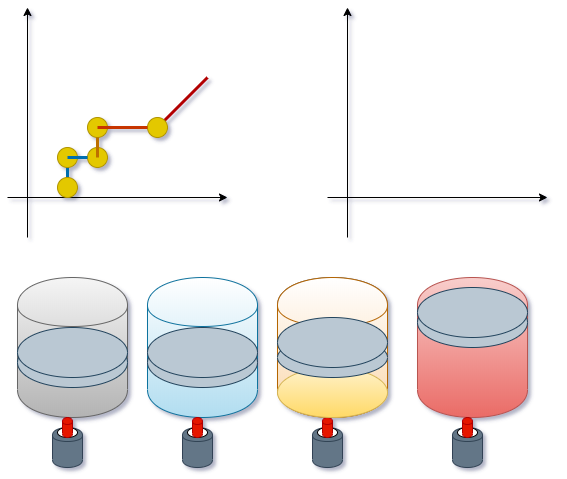
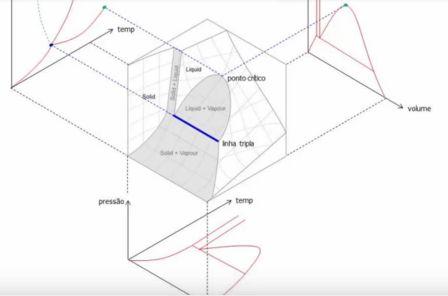
Sabemos que uma substância
pode existir em três fazes diferentes: sólida
líquida e gasosa. Considere um experimento em
que o sólido "gelo" esteja contido dentro de um
cilindro com pistão, de tal maneira que a
pressão seja mantida constante. Nestas
condições, o cilindro é aquecido, fazendo com
que a substância experimente as três fases. A
temperatura e o volume serão registrados durante
todo o processo.Começando com o sólido a uma
temperatura baixa, como no ponto"A" do diagrama
da figura abaixo até chegar ao estado de vapor
saturado, após o qual a temperatura aumenta
novamente com o fornecimento de energia. Os
volumes específicos do sólido e do líquido são
muito menores que volume específico do
gás. As figuras abaixo estão em uma escala
exagerada para que as diferenças sejam notadas.
2. Equações de Estado
2.1 volume específico molar médio
|
|
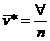
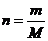 |
n
®
número de moles
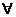 ®
volume ®
volume
m
®
massa
M
®
massa molar |
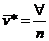 =
=
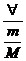 =
=
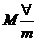 Þ
Þ
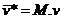
2.2
Equação do estado de um gás ideal
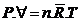 Þ
Þ
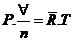 Þ
Þ
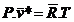
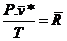 Þ
Constante universal dos gases
Þ
Constante universal dos gases
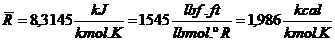
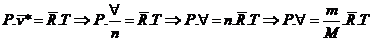 Þ
Þ
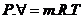

Constante
do gás
Diagrama de
estado
A representação gráfica da
dependência entre a pressão e a temperatura de
uma substância em diferentes estados é conhecida
com o nome de diagrama de estado.
O diagrama de estado da
água apresenta o seguinte aspecto:
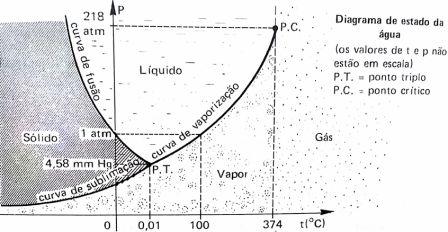
Interpretação do
diagrama:
Os pontos sobre a curva de
fusão apresentam as pressões e temperaturas de
fusão do gelo.
Os pontos sobre a curva de
vaporização representam as pressões e
temperatura de ebulição da água.
Os pontos sobre a curva de
sublimação representam as pressões e temperatura
de sublimação do gelo.
Entre as curvas de fusão e
sublimação estão os pontos representando as
pressões e temperaturas do gelo.
Entre as curvas de fusão e
vaporização estão os pontos representando as
pressões e temperatura da água líquida.
Abaixo da curva de
sublimação e vaporização estão os pontos
representando as pressões e temperaturas do
vapor de água.
O ponto triplo da água é
assim designado, pois a temperatura de (0,01°C)
e pressão (4,58 mm de Hg) coexistem em
equilíbrio os três estados: gelo, água e vapor.
A temperatura e pressão
crítica para água: (374/C) e (218 atm) Acima da
temperatura crítica temos gás de água.
2.3 Fator de
Compressibilidade (z)
Ajuda determinar se a equação do gás ideal pode
ou não ser usada. (Quando Z = 1 ou bem próximo
de 1 ela pode ser usada).
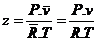
2.4
Processos Termodinâmicos
Teremos um processo termodinâmico
sempre que variar pelo menos uma das
propriedades termodinâmicas
AB
Þ
Isobárico
Þ
n = 0
AC
Þ
Isotérmico
Þ
n = 1
AE
Þ
Isométrico
Þ
n =
¥
AD
Þ
Isoentrópico
Þ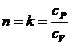
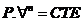 n
= expoente politrópico.
n
= expoente politrópico.
Comentário1:
Processo Isométrico
Þ n =
¥
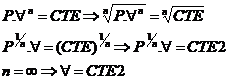
Comentário2:
cP = calor
específico à pressão constante
cV = calor
específico a volume constante
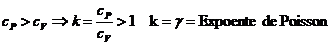
É
a razão entre massa de vapor saturado e massa
total.
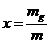
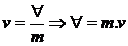
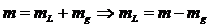

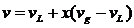
Exercícios
1.
Qual é a massa de ar contida em uma sala de 6 m
X 10 m X 4 m, se a pressão é 100 kPa e a
temperatura é 25 °C? Admita
que o ar se comporte como um gás ideal (R =
0,287 kN.m/kg K). (280,5 kg)
2. Um tanque tem um volume de 0,5 m3
e contêm 10 kg de um gás ideal que apresenta uma
massa molecular igual a 24. A temperatura é de
25 °C. Qual é a pressão no gás? (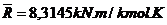 )
(2066 kPa)
)
(2066 kPa)
3. Nitrogênio (M = 28,01 kg/kmol) é contido em
um recipiente de 4 m3 a pressão de
4200 kPa. Determine a massa se a temperatura for
de (a) 30 °C e (b) -120 °C. (186,8 kg, 369 kg)
4. Um pneu de automóvel com volume de 0,6 m3
é inflado até alcançar uma pressão manométrica
de 200 kPa. Calcule a massa de ar no pneu se a
temperatura é de 20 °C (suponha o ar como um gás
ideal). R =
0,287 kN.m/kg K) (2,14 kg)
5. Um tanque isolado termicamente cujo
volume é desconhecido está dividido em duas
partes. No lado esquerdo, temos 0,01 m3
de ar à pressão de 0,8 MPa e temperatura
ambiente (25 ºC), enquanto que o outro também
contem 1 kg de ar mas à pressão de 1,2 MPa e
temperatura de 55 ºC. A divisória é removida e o
ar de um lado do tanque interage com o ar do
outro lado do tanque. A condição final é de
temperatura de 10 ºC e pressão de 120 kPa.
Determine o volume total do tanque. Dado: RAR
= 0,287 kJ/kg.K. (0,74 m3/kg)
6. 1,5 kg de CO2 são aquecidos em um
recipiente mecanicamente isolado de volume 0,05
m3 desde a temperatura de -20 ºC até
90 ºC. Determine as pressões inicial e final. (P1
= 1434,7 kPa, P2 = 2058,2 kPa)
7. Um tanque de 1 m3 contendo ar a 25
C e 500 kPa é conectado através de uma tubulação
com uma válvula, inicialmente fechada, a outro
tanque, este contendo 5 kg de ar a 35 C e 200
kPa. A válvula é aberta e todo o sistema
interage até que a condição de equilíbrio de
temperaturas é alcançada com o exterior, que
está a 20 C. Determine o volume do segundo
tanque e a pressão final de equilíbrio do ar.
Dado: RAR = 0,287 kJ/kg.K.
(2,211 m3,
284,11 kPa)
8. Ar em um pneu de automóvel de volume 0,70 m3
está a 30 ºC e pressão manométrica de 150 kPa.
Determine a quantidade de ar que deve ser
adicionado ao pneu para que a pressão interna
alcance o valor de 200 kPa, também manométrica.
Considere que a pressão atmosférica loca é 100
kPa e que a temperatura e o volume permanecem
constantes. RAR = 0,287 kJ/kg.K.
(0,40 kg)
9. Qual o volume específico
do vapor formado quando água entra em ebulição à
pressão atmosférica normal? (1,6729 m3/kg)
10. Qual o volume específico de uma mistura de
água líquida + vapor a 50
ºC se o
título for de 45%?
(5,415 m3/kg)
11. Encontre a temperatura e o volume específico
da água à pressão 3,0 MPa e título de 0,95.
(233,9 ºC, 0,063406 m3/kg)
12. Se o volume específico
da água for 0,05 m3/kg e a
temperatura é 225 C, qual é o título? (0,63139)
13. À pressão de 500 kPa e título de 30%, qual é
a temperatura e o volume específico da água?
(151,86 ºC, 0,3749 m3/kg)
Clique aqui
para acessar a resolução dos exercícios